在7月8日国家卫生健康委发布的“健康中国行动”中,我国的人均预期寿命提高到77.93岁,主要健康指标居于中高收入国家前列。在这一欣喜数据的背后,我们还应警惕随之而来的“老龄化问题”。
老龄化问题的根源之一在于“老年病”的多发。而在所有的老年病中,阿尔兹海默病(老年痴呆)无疑是最受人关注的疾病之一。
然而,时至今日,虽然经过几十年研究,我们对于阿尔兹海默病(老年痴呆)的病因、病程以及治疗方法仍然处于起步阶段,许多机制仍处于未知状态。
7月6日,Science advances在线发表了澳大利亚Arne Ittner 博士课题组关于阿尔兹海默病(AD,老年痴呆)的最新研究成果《Alzheimer’s disease: Ablating single master site abolishes tau hyperphosphorylation》。大量研究表明,tau蛋白与大约20多种神经退行性疾病相关。这项研究揭示了阿尔兹海默病中在复杂的 tau 蛋白磷酸化是如何产生的,从而为阿尔兹海默病的治疗和生物标志物设计提供了参考。

阿尔兹海默症作为高知名度的神经退行性疾病,时至今日仍然没有完全治愈的方法。阿尔兹海默病最为典型的两大特点是β-淀粉样蛋白和Tau 蛋白在神经元内累积。Tau 蛋白是神经纤维缠结的主要组分,也是阿尔茨海默症等一系列神经退行性疾病的标记物。
在阿尔茨海默症发病过程中,tau 蛋白的异常磷酸化会导致配对螺旋样纤维 (PHF) 和神经纤维缠结 (NFT) 的形成。这会引起细胞内阻塞,破坏细胞并引发神经元功能障碍,最终导致认知能力下降。
然而关于tau 蛋白特异性位点和过度磷酸化之间的联系仍然未知。因此,这一项研究就从这个角度出发,证明了两者之间的关系。
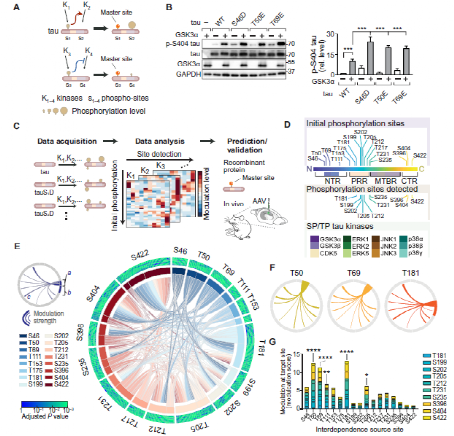
Fig.1 Interdependence defines master sites integral to tau multi-site phosphorylation.
为了解决tau蛋白位点与磷酸化之间的关系,研究人员猜想:tau蛋白磷酸化在不同位点间是“相互依赖”的,即一个位点的初始磷酸化会调节另一个位点的磷酸化状态。通过体外培养293T细胞表达不同的tau蛋白突变体,研究人员对这种相互依赖式的磷酸化位点进行了筛选研究。通过SDS-PAGE、Immunoblots等方法研究人员获得了以下三方面数据:(i)SP/TP前位点磷酸化,(ii)SP/TP激酶活性增加,和(iii)SP/TP位点磷酸化状态。
进一步地,研究人员将这种方法扩展到17个SP/TP初始磷酸化位点和12个激酶,产生了10个与激酶活性和初始磷酸化有关的多维数据集。对12个SP/TP激酶的分析证明了研究人员最开始的猜测,即不同的磷酸化位点间存在相互依赖性,并且主要表现为正调节。对上述数据集进行聚类分析后,研究人员发现T181,T205,T212,S404和S422是PRR和CTR内通过tau磷酸化相互依赖性调节的主要位点。此外,研究人员还发现对连续 tau 磷酸化的关键贡献来自 NTR 和 PRR 中特定主位点的初始磷酸化,初始磷酸化可以改变激酶对 tau 蛋白的位点特异性活性。
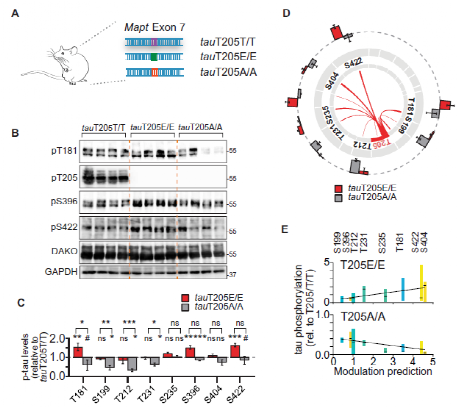
Fig.2 Master site Interdependence controls endogenous tau phosphorylatlon In vivo.
为了验证上述机制是否也存在于健康大脑中。研究人员对tau蛋白 的 AT8 表位内的关键残基T205进行了分析研究。通过CRISPR-Cas9敲除小鼠模型,研究人员证实了在 T205可调节多个表位的生理性 tau蛋白磷酸化,并且在体外培养细胞中预测的位点相互依赖性适用于脑组织中的内源性 tau蛋白。
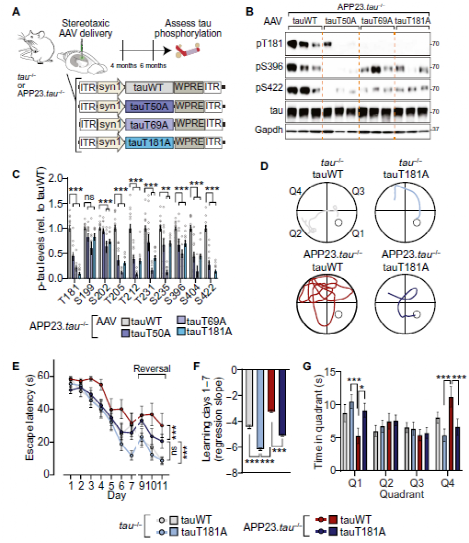
Fig.3 Master site interdependence governs human tau phosphorylation and Aß-tau-induced cognitive impairment in vivo.
由于小鼠和人在tau 蛋白上具有高度相似的磷酸化表位,因此,在小鼠模型上的实验结果也可类推到人身上。研究人员又通过表达人tau蛋白与其突变体的阿尔兹海默症转基因小鼠模型对T50,T69和T181等三个主要位点进行了验证,结果与研究人员的相互依赖性预测一致,在多个病理相关表位上,人tau蛋白的Aβ相关磷酸化受主位点调控。此外,主位点T181的消融调节了Aβ相关认知缺陷。
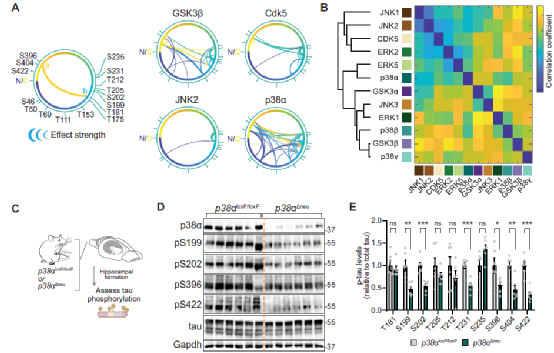
Fig.4 MAP kinase p38a is a multi-site tau kinase in vivo.
进一步分析表明,p38α是相互依赖的作用机制下,小鼠体内神经元中的 tau蛋白发挥作用的主要激酶。

Fig.5 Removal of single master site and kinase p38a abolishes tau multi-site hyperphosphorylation.
最后,研究人员又对p38α-tau 相互作用机制中的主要位点T50A、T69A 和 T181A进行了分析。结果发现T50、T69 或 T181 的消融使 tau 不太容易在多个位点被 p38α 磷酸化,而p38α 对 T181 的磷酸化先于 PRR 的后续多位点磷酸化。并且激酶反应中的 CTR 表位在不同的时间点停止。这些结果表明与p38α协同作用的主要位点的磷酸化是多个表位上广泛且相互依赖的tau磷酸化所必需的。
综上所述,这项研究为我们揭示了在阿尔兹海默症中的关键蛋白tau是如何进行特异性磷酸化和过度磷酸化,并对其不同位点的磷酸化相互作用进行了分析。为我们了解阿尔兹海默症的发病原因,开发针对性的药物提供了新策略。
参考文献:
1.Arne Ittner.et al. Alzheimer’s disease: Ablating single master site abolishes tau hyperphosphorylation. SCIENCE ADVANCES.6 Jul 2022.Vol 8, Issue 27
来自: 生物谷