今天,分享一篇冷催化纳米酶首个案例问世,科学家提出冷催化抗肿瘤技术,将推动智能人工酶的发展,希望以下冷催化纳米酶首个案例问世,科学家提出冷催化抗肿瘤技术,将推动智能人工酶的发展的内容对您有用。
来源:DeepTech深科技
“有一次我开车带学生送样品,晚高峰车流量很大,路上出了交通事故。另外,我们团队属于化学化工学院,生物部分的仪器平台都在医学院校区。为了使用仪器设备,学生经常凌晨 4 点就得到实验室。几经折腾,我认为很有必要搭建一个完善的仪器平台。为此,我凑集所有科研经费,还借了同事的科研经费,将实验平台建设得更加完善,并且还对外开放使用,给周边课题组也带来了方便。当学生做实验不再需要东奔西走,我觉得自己尽到了研究生导师的基本责任。”中南大学化学化工学院教授陈万松说。

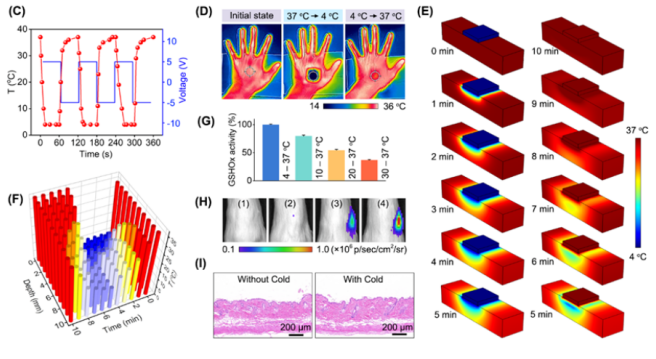
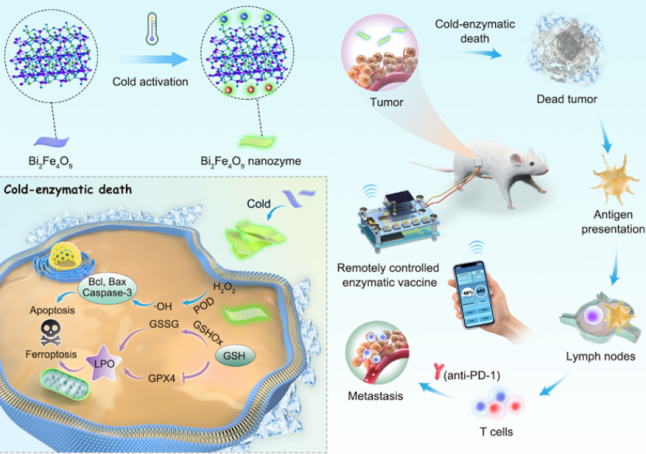
如今,他不仅尽到了照顾学生的责任,还带领学生研发出一种冷催化抗肿瘤的技术。当利用热释电纳米材料时,该技术可以开展冷温(4℃- 37℃)范围内的催化抗肿瘤治疗。
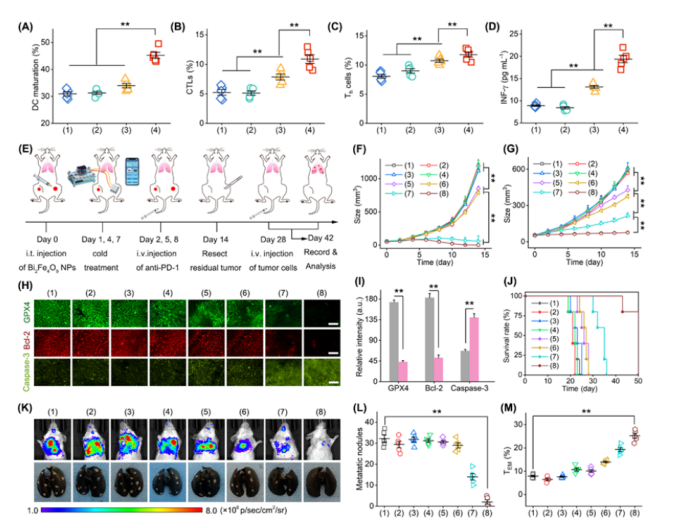
具体来说,在肿瘤组织处,通过冷温来开启铁酸铋纳米片的谷胱甘肽过氧化物酶活性,借此催化肿瘤细胞以让其释放肿瘤抗原,同时激活免疫系统建立全身的抗肿瘤免疫。
而在正常组织处,则可通过关闭冷温,来关闭铁酸铋纳米片的谷胱甘肽过氧化物酶活性。
此外,为实现智能化和便携化的治疗,课题组又设计一种可以远程控制冷温的介入治疗装置,通过手机即可实现远程控温,精确地调节铁酸铋人工酶的抗肿瘤免疫治疗过程。
 (来源:ACS Nano)
(来源:ACS Nano)可以说,利用冷温控制人工酶的活性是一种非常有意思的想法,冷催化介入治疗器件的设计也非常智能化,符合未来智能医疗的发展方向,能给人工酶的开发以及智能化纳米药物的研究带来新的技术支撑。
未来,它有望用于以下领域:首先是肿瘤治疗,当前肿瘤治疗的毒副作用太大,热灌注治疗和光热消融治疗都是以高温促进肿瘤细胞的死亡,这两种方式对于正常组织都存在热损伤的风险。
而该工作提供了一条相反的思路,采用对人体更加安全的冷温进行肿瘤治疗,故有潜力成为热疗的替代和补充方案。
其次,冷温纳米酶可以推动智能人工酶的发展。天然酶可以催化的底物很多,但是目前能用于疾病治疗的酶很少,主要缘故就是因为天然酶的活性很难控制。
举个最简单的例子,肿瘤的糖酵解代谢导致乳酸积累,乳酸氧化酶能够氧化乳酸和过氧化氢,诱导肿瘤细胞凋亡,这个过程非常高效。
但是该团队在动物身上做实验时发现,患肿瘤小鼠接受乳酸氧化酶治疗后的死亡率接近 100%,即使是正常小鼠也很容易死亡。
后来,他们发现乳酸氧化酶不仅能够氧化肿瘤内的乳酸并产生毒性,也能够氧化血液中的乳酸产生全身性毒性。
因此,课题组提出了冷温控制酶活性的方法来克服此类问题。后续,他们希望该方法能控制更多的酶活性,从而推动智能人工酶的发展。
 (来源:ACS Nano)
(来源:ACS Nano)
冷催化纳米酶的首个案例
据陈万松介绍,酶是人类维持正常机体代谢和生命活动重要的催化剂,酶也可以作为药物成分进行疾病治疗。将酶用于癌症治疗时,酶能够以癌细胞自身具有的代谢物质为底物,催化转化为具有杀伤能力的抗癌物质。
相比当前临床上使用的化疗药物,酶类药物更加高效,且抗癌物质是经过原位转化产生,可以避免传统纳米药物在体内递送过程中的泄露问题,能够更有效地完成肿瘤杀伤。
尽管酶类催化剂具有这些优点,但是假如酶类催化剂分布在正常组织,也有可能在里面进行催化反应并产生毒性物质。
因此,陈万松团队希望酶的催化活性能够按照临床需要打开和关闭,即在肿瘤部位开启催化活性,而在正常组织里则是关闭催化活性,这样才能实现有的放矢。
然而,当前几乎所有的酶催化剂均不具备这样的开关功能,那么如何实现酶催化活性的开关呢?
温度是影响酶催化反应的关键性因素之一,因此通过温度来精准地控制人工酶的活性,是一种简单且有效的策略。
目前,临床上通过温度控制的治疗方式,包括热灌注治疗和光热消融治疗,这是在 42℃ 以上的高温下进行的肿瘤热治疗。
但是对于正常组织来说,特别是脑组织等热敏感部位,42℃ 及以上的温度会引起正常组织的不可逆损伤。
要知道,人体细胞更加耐冷(4℃- 37℃),而且冷温的安全范围(4℃- 37℃)比高温的安全范围(37℃ - 42℃)更宽。为了打破这种局面,他们打算攻关这一课题,并完成了前文的技术突破。
 (来源:ACS Nano)
(来源:ACS Nano)
做真正“厉害”的科研
据介绍,课题在设计之初,该团队原本计划开发温度响应的催化纳米药物,基于他们前期在无机纳米材料上的研究基础,完成了对压电纳米材料的筛选,最终确定使用铁酸铋纳米片作为温度响应的催化纳米药物。
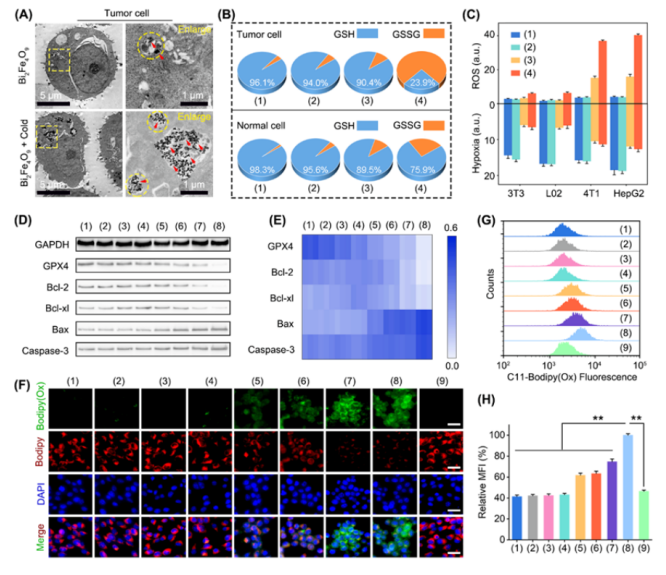
接下来是冷催化纳米酶概念的建立。在完成纳米药物的制备之后,他们其实并没有和酶建立联系。直到在细胞水平上进行测试时,发现这样的治疗方式能够很快杀死肿瘤,而且基本不影响正常细胞的活性。
经过一系列的研究分析,他们发现造成这种选择性消灭肿瘤的结果,与肿瘤细胞内高表达的代谢物有关,这一现象和酶对底物的选择性催化作用非常类似。
因此,课题组将铁酸铋纳米片的催化过程与人工酶的概念联系起来,并且通过酶促反应动力学的测定和理论模拟,进一步确立了这一结论。
最后是器件的设计与搭建。研究团队在测试中发现,控制温差的过程虽然看似简单,但在实际操作中需要频繁改变体系的温度,这对于未来实际应用来说非常繁琐。
而目前市场上也没有仪器能在短时间内进行升温和降温的反复切换。陈万松说:“偶然一次机会中,团队成员了解到半导体制冷片能够瞬间致冷。经过电路的设计和优化,通过自动切换电流方向,我们在手机蓝牙控制之下,实现了半导体制冷片的制冷和制热的周期性交替,整个温控过程也变得更加便捷和智能化。”
 (来源:ACS Nano)
(来源:ACS Nano)后面,他计划将冷催化纳米酶治疗与临床应用结合,目前也正在与脑科医生合作,以探索冷催化治疗的实际应用潜力,力图在脑肿瘤治疗上真正实现应用。
此外,其还将发展可生物降解的冷催化纳米酶,从而提高冷温催化纳米酶的生物安全性。
同时,也将拓展冷催化纳米酶的范围。陈万松说:“我们这项工作仅仅是冷催化纳米酶的首个案例,相信未来会有更多的冷催化纳米酶会被开发出来。”
另据悉,陈万松硕士和博士均毕业于中南大学,如今又在这里工作。他说:“做学生时主要考虑着发论文,导师也很宽容允许我们自由地选题,所以在学生阶段我尝试了很多方向,积累了经验和知识面。做老师后,我认识到科研工作要站在更高的层面和视角,要做有用和有特色的研究工作。”
他说,之前在学生阶段觉得厉害的科研就是高影响力的论文成果;成为老师之后,他觉得厉害的科研应该是解决国家重大需求和行业瓶颈问题的研究成果。“我认为中南大学很厉害的一个地方就是校训‘知行合一、经世致用’,我们学院有很多老师在成果转化和产业化方面做了很好的范例,也指引着我们秉承校训、砥砺前行。”陈万松表示。
参考资料:
1.Zou, Y., Jin, B., Li, H., Wu, X., Liu, Y., Zhao, H., ... & Liu, Y. N.(2022). Cold Nanozyme for Precise Enzymatic Antitumor Immunity. ACS nano, 16(12), 21491-21504.