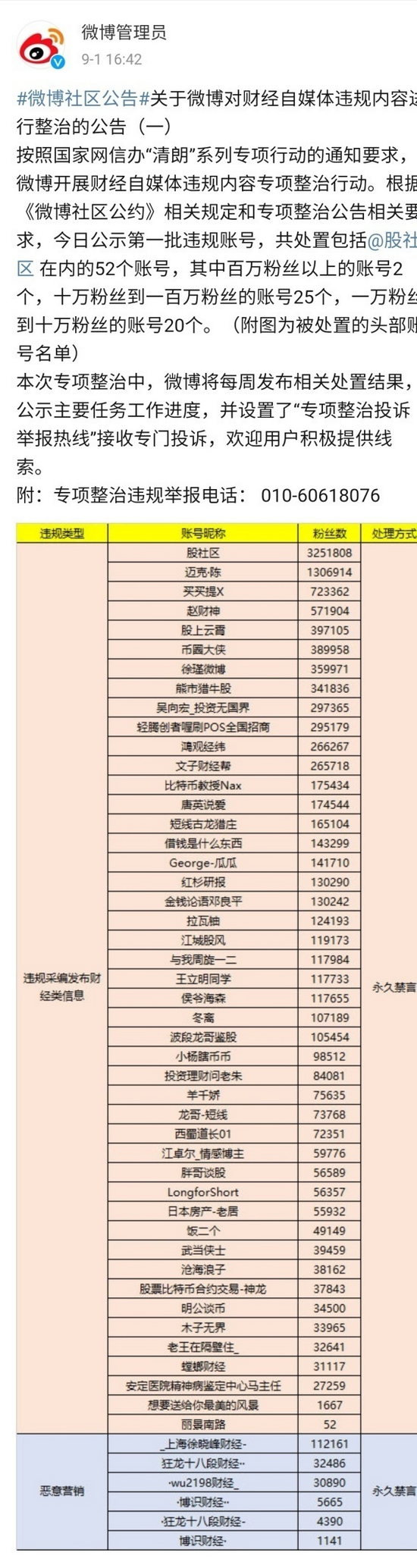
原标题:新冠“特效药”竞速:全球在研项目上百,中国近10款进入临床

在多方因素助推之下,新冠中和抗体市场入局者越来越多,整体竞争也将进入焦灼态势。
新冠肺炎疫情全球大流行下,“疫苗+特效药”被认为是最佳的防治组合手段。目前新冠疫苗已经取得巨大成功,而“特效药”有望成为终结新冠疫情的最后一张拼图。
在众多治疗新冠药物研发中,中和抗体被认为是有望成为新冠“特效药”最大突破口之一,也吸引了中外药企争相布局。
近日,国内新冠中和抗体药物研发不断传来好消息。济民可信集团宣布,其自主研发的新冠病毒特异性中和抗体注射液已完成I期临床试验, 以期为COVID-19的治疗贡献力量;君实生物宣布FDA 已经恢复其与礼来合作的抗体鸡尾酒疗法 bamlanivimab/etesevimab 的分发。
据不完全统计,目前国内在研治疗新冠中和抗体药物至少有10款:君实生物和中科院微生物所联合开发的JS016、腾盛博药的两款中和抗体BRII-196和BRIII-198、迈威生物的MW33 、神州细胞的SCTA01、绿叶制药LY-CovMab、复宏汉霖HLX70、济民可信JMB2002等进入临床试验阶段。此外,国药集团中国生物杨晓明团队也发现了对多种新冠变异株有效的单克隆抗体,目前该2B11抗体的临床申报工作正有序推进。
中和抗体能有效阻碍新冠病毒进入人体细胞,是治疗新冠肺炎的有效手段。不过,随着入局者越来越多,竞争也将趋于焦灼状态。为了进一步推动及规范本土创新药企在新冠肺炎治疗药物的临床试验,9月3日,国家药品监督管理局药品审批中心(CDE)发布了关于公开征求《新型冠状病毒肺炎抗病毒治疗及预防新药临床试验技术指导原则(试行)》(征求意见稿)意见的通知(以下简称《指导原则》)。
对此,有业内人士对21世纪经济报道表示,该文的发布有望进一步推动国内各生物制药企业正在进行的针对新冠肺炎治疗的各类抗体药物的研发进展,助推更多抗体药物加速获批。
新冠中和双抗成热门赛道
据Antibody Therapeutics数据库统计,截至2020年9月,全球共有98个靶向新冠病毒S蛋白的中和抗体项目。其中,全球范围内已有3款中和抗体或组合疗法获得FDA紧急使用授权,包括再生元的casirivimab/imdevimab联合疗法、礼来/君实生物合作开发的etesevimab/bamlanivimab联合疗法、葛兰素史克与Vir Biotechnology合作研发的Sotrovimab。
再生元2020年7月初获得美国政府满足7-30万患者的治疗剂量(或42-130万患者的预防剂量)订单;2020年8 月与罗氏合作后,再生元生产抗体药物的能力将至少提升3.5倍。
根据再生元(Regeneron)公布的上半年业绩报告,第二季度营收51.4亿美元,同比增长163%。净利润为31亿美元,同比增长245%。其中,来自新冠中和抗体REGEN-COV收入为27.6亿美元,占到再生元该季度收入的54%。
财报数据显示,再生元与罗氏联合开发的REGEN-COV(美国以外国家及地区商品名:Ronapreve)已于7月20日首次获日本厚生劳动省批准,用于治疗轻中度COVID-19感染患者,并且已经在欧盟及美国获得紧急使用授权(EUA)。FDA还在7月31日将EUA人群范围扩大至暴露前预防,后续还将扩大至住院患者。再生元负责记录该产品在美国的收入,罗氏负责美国以外国家和地区。REGEN-COV上半年在全球的销售额已经达到35.1亿美元。
礼来方面,在今年2月,美国政府已决定采购至少10万剂etesevimab(JS016或LY-CoV016)1400mg和bamlanivimab(LY-CoV555)700mg双抗体疗法用药,协议金额为2.1亿美元,在2021年11月25日之前,美国政府有权根据与基础协议相同的条款,并综合礼来方面的一致意见、产品供应水平、医疗需求这些前提,额外购买110万剂。
礼来公布截至2021年6月30日第二季度财报数据显示,礼来上半年总收入135.46亿美元,同比增长19%。其中,新冠中和抗体在2020年为礼来带来8.71 亿美元的收入后,在2021上半年继续增长,实现9.59亿美元收入,同比上半年增幅为11%。
针对中和抗体的市场表现,兴业证券分析报告分析称,2020年底,预计中和抗体的商业化市场空间约18.3-38.4亿美元,2021年末,预计中和抗体的市场空间可达68.7-146.4亿美元。其中欧美发达国家市场空间更大,达到54.3-110.4亿美元;发展中国家市场规模约14.4-36.0亿美元。另一方面,中和抗体用于患者治疗的市场空间更大,约62.4-132.0亿美元;用于高风险人群预防时,因为价格高、预防时间短等劣势,疫苗研发成功后很容易被替代,市场规模相对较小,或将不超过10亿美元。
面对百亿美元级的市场规模,国内药企也争相入局。目前,本土企业中,君实生物和中科院微生物所联合开发的JS016、腾盛博药的两款中和抗体BRII-196 和BRIII-198、迈威生物的MW33 、神州细胞的SCTA01、绿叶制药LY-CovMab、复宏汉霖HLX70、济民可信JMB2002等已进入临床试验阶段。
其中,君实生物的JS016领跑,是中国第一个、全球第二个进入临床试验的新冠病毒中和抗体疗法。该候选药物也受到的礼来公司的青睐,双方于2020年5月4日达成协议,礼来以最高2.55亿美元的价格买断JS016大中华区以外的临床开发和商业化权益。目前JS016单药的国际多中心(包括中国)Ib/II期临床试验已经完成,海外双抗体疗法用于治疗的III期已经达到主要终点和关键次要终点;绿叶制药8月初宣布LY-CovMab已获准在中国开展II期临床试验;腾盛博药8月底宣布其新冠中和抗体BRII-196/BRII-198联合疗法三期试验获积极数据;济民可信9月6日宣布完成JMB2002注射液的I期临床试验。
而随着新冠肺炎病毒变异株的不断出现,针对中和抗体市场的布局者也是越来越多,中和抗体市场竞争已经进入白热化阶段。
资本推动下的中和抗体市场
实际上,从中国药品市场销售的增长来看,目前,我国医药市场年增长率可以达到12%,远远超过全球4.6%,国内资本对创新研发的投入也保持在平均每年约20%的速度在增长,申报临床的创新药品种也呈逐年上升的趋势。不过,在这些繁华的背后,隐患也逐渐凸显出来,作为一个高科技、高投入、高风险领域,近年来这一行业的门槛却被低水平创新拉低。
对此,轩竹生物科技有限公司CEO李嘉逵在2021年全国医药工业信息年会上表示,创新药企要发挥自己完善的全产业链研发平台的优势,在立项的时候缩短和国际上新靶点立项的时间差,做到快速转化。同时,寻求差异化的发展路径,探索新的适应证实现临床价值。
轩竹生物在今年1月宣布收购康明百奥100%的股份,引入“Mab Edit”(抗体编辑)和“Mebs-Ig”(抗体编辑的双特异抗体)两大抗体技术平台。在绝大多数药企聚焦布局新冠肺炎中和双抗时,轩竹生物已经开始布局抗Ebola(埃博拉传染病)ZMAPP三联创新抗体药物KM219、抗冠状病毒中东呼吸综合症MERS抗体KM211、抗体融合蛋白长效降糖药物KM320、KM119(膀胱癌与卵巢癌)、免疫检查点双抗KM216(肺癌)免疫检查点双抗KM218(实体瘤)等产品管线。
“中国创新药通过十年的发展至今以处于转折点,今后的十年里,我们需要完成从量变到质变的过程,建立创新的生态体系,其中包括创新的政策制度,创新的技术和研发水平,创新的支付体系。”李嘉逵说道,无论是传统化学药物、单抗、双抗还是特异个性化的疫苗,最终都是以临床为价值导向进行研发,而不是以整个市场和资本的指引为方向。与此同时,在行业都在聚焦新冠肺炎治疗药物市场时,规范行业标准,有针对性的差异化布局的企业往往更能胜人一筹。
和记黄埔医药(上海)有限公司首席科学家苏慰国也表示,创新驱动是药企核心发展的重点,
在新药创新方面需要聚焦新靶点的研究同时,做好临床转化也是至关重要。
“目前,我们可以看到很多在研的项目,中和双抗甚至多抗占有较大的比例。这也是由于不少科学家认为,结合了不同的靶点才有希望得到更好临床的疗效,但是这些项目无论是在技术还是基础研究上并未成熟,需要更长时间、更多的投入。另外,对企业来说,在新冠肺炎的疫情和资本推动下,扎堆研究新冠肺炎治疗药物,如中和抗体药物成为常态,但这很可能带来后续的产品几乎没有临床价值,也没有市场的价值,所以,企业需要做好权衡。”苏慰国说道。
华兴证券研究所负责人、医药行业首席分析师赵冰博士在接受21世纪经济报道记者采访时表示:“在新冠肺炎治疗药物市场领域也是同样的情况。目前,布局中和抗体的企业很多,但是是否用于新冠治疗是个好选择,还不一定。如果有便宜廉价的化学药率先上市,中和抗体就不一定有市场竞争力了,所以背后的风险也亟需做好把控。”
眼下,在疫情的机遇与挑战并存的市场环境下,创新药企业迎来蓬勃发展,新生代的创新药公司在成立10年内市值可以超过许多传统制药巨头,这也使得高速发展之下的各类问题愈发彰显。
CDE发文剑指新冠肺炎治疗药物
为了进一步推动及规范本土创新药企在新冠肺炎治疗药物的临床试验,9月3日,国家药品监督管理局药品审批中心发布关于公开征求《新型冠状病毒肺炎抗病毒治疗及预防新药临床试验技术指导原则(试行)》(征求意见稿)意见的通知,明确指出,为促进新型冠状病毒肺炎抗病毒 药物研发,规范临床试验设计, 特制定此次的指导原则。该指导原则适用于预防、治疗新型冠状病毒肺炎的化学药物和生物制品(预防用疫苗和恢复期血浆治疗除外)。
在《指导原则》出台后,有业内人士对21世纪经济报道记者表示,该文的发布有望进一步推动国内各生物制药企业正在进行的针对新冠肺炎治疗的各类抗体药物的研发进展,助推更多抗体药物加速获批。“毕竟,在此文件发布之前,不少生物制药企业对于抗体药物的研究虽然很多,扎堆进行,但是依旧有很多公司不知道应该如何设计临床,更好的进行临床试验研究。”该人士说道。
对于此次《指导原则》的发布,赵冰博士认为,这是针对所有新冠的治疗、预防药物,不仅仅指中和抗体,而随着这一文件发布,“群魔乱舞”的现象将有望得到遏制。与此同时,在CDE的指引下,针对新冠肺炎治疗的相关药物机制将会更为明确。
“此次CDE制定此《指导原则》的目的是‘促进新型冠状病毒肺炎抗病毒药物研发,规范临床试验设计’,对于坚持科学规范研发路径的申办方,不存在‘提高准入门槛’的影响。” 君实生物医学科学部高级医学总监李卿在接受21世纪经济报道记者采访时也表示,君实生物目前在研的相关产品一直遵循科学规范的研发路径,并保持与监管和临床专家及时沟通。我们中和抗体药物的临床试验标准是高于《指导原则》标准的,没有影响。
在美国暂停供应双抗体疗法后一个月,8月27日,美国宣布已经重启礼来/君实新冠中和抗体的分发。而根据公开资料,之所以做出这一决定,是因为美国疾控中心(CDC)监测美国巴西突变株(P.1)与南非突变株(B.1.351)比例已经超过11%。体外分析试验中,礼来/君实中和抗体对这两种突变体没有中和活性。再生元的中和抗体对这两种突变体仍有中和活性,因此使用不受突变株影响。
除此之外,疫情形势严峻也成为美国作此决定的重要因素,在德尔塔突变株大流行的背景下,德尔塔突变型感染者占美国所有已确诊COVID-19病例的近96%。本次双抗体疗法在美国恢复分发,仍包括了对双抗体疗法授权使用的限制。FDA仅允许在对双抗体疗法具有耐药性突变型流行率较低的州、领土及美国司法管辖区使用。
根据君实生物公开的数据,截至目前双抗疗法已恢复授权使用的州、领土及美国司法管辖区合计22个,尚未恢复授权使用的州、领土及美国司法管辖区合计37个。
目前,新冠药物以化学药和大分子生物药为主流,主要包括RdRP抑制剂、蛋白酶抑制剂、中和抗体、大分子非中和抗体药。随着新冠肺炎疫情逐渐常态化,中和抗体的长期价值将会愈发凸显,多款治疗性药物将进入关键的后期临床阶段。后续谁将抢占更多市场份额,值得关注!
(作者:季媛媛 编辑:徐旭)