今天,分享一篇中国学者发现调控病理性核蛋白传播的全新机制,鉴定大量新型修饰位点,有望提供潜在药物靶点,希望以下中国学者发现调控病理性核蛋白传播的全新机制,鉴定大量新型修饰位点,有望提供潜在药物靶点的内容对您有用。
来源:DeepTech深科技
UCLA大卫格芬医学院助理教授彭超、美国宾夕法尼亚大学佩雷尔曼医学院李文渝教授为该论文的共同通讯作者,UCLA 博士后研究员张舒静、朱若玮为论文的第一作者。

为相关疾病的治疗方案提供全新思路
过去十年已经有越来越多的证据指出,包括阿尔兹海默症、帕金森病在内的相关疾病与病理性 α-突触核蛋白或错误折叠蛋白密切相关。简单来理解,正是由于大脑中错误折叠蛋白的沉积,导致了相关疾病的产生。
并且,一旦病理性 α-突触核蛋白在神经网络中传播,会影响越来越多的神经元,相关疾病的病情也会随之加重。因此,通过阻断或延缓病理性 α-突触核蛋白的传播可控制相关疾病,对病理性 α-突触核蛋白的研究具有巨大的疾病治疗潜力。
该研究发现的契机缘于彭超团队受Nature Reviews Neurolog邀请撰写一篇综述。该团队在系统地梳理和总结病理性 α-突触核蛋白已有知识的过程中发现,之前所有关于病理性 α-突触核蛋白的研究都集中在病理性 α-突触核蛋白本身,包括其运动方式、被细胞释放或吞噬等。
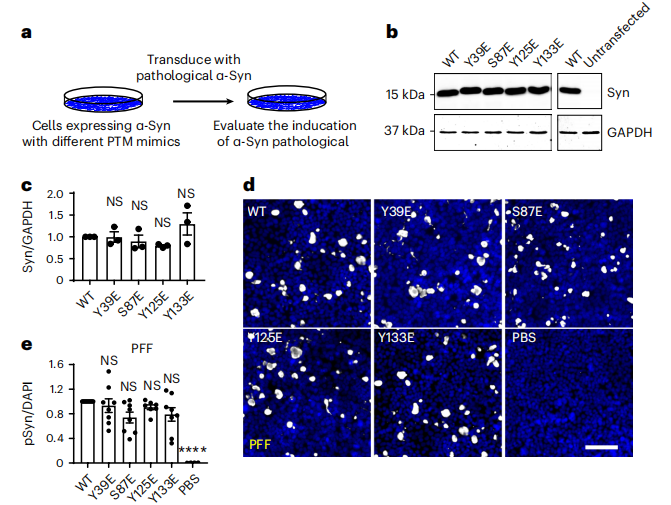 图丨可溶性α-突触核蛋白磷酸化调节病理性α-突触核蛋白扩增(来源:Nature Neuroscience)
图丨可溶性α-突触核蛋白磷酸化调节病理性α-突触核蛋白扩增(来源:Nature Neuroscience)该团队注意到,病理性 α-突触核蛋白传播后需要扩增,也就是说,它到新的细胞后需要在细胞里对自己进行复制并扩增,以影响更多的神经细胞。一旦需要自我复制,就涉及到病理性 α-突触核蛋白招募细胞中正常蛋白,并将其转变为病理性 α-突触核蛋白。
于是,他们从一种全新的角度思考提出了一个关键问题,这些被招募的正常蛋白会不会起到某种调控扩增的作用呢?实际上,这种正常蛋白正是扩增的底物。
该团队首次揭示了正常蛋白对于病理性 α-突触核蛋白的扩增具有重要的调节功能。并且,当其底物有不同修饰时,会严重地影响病理性 α-突触核蛋白的扩增。
“这说明,在今后的研究中不能只关注在病理性 α-突触核蛋白本身,还应该关注在他的扩增过程中起到关键性作用的可溶性底物蛋白,例如与阿尔茨海默病相关的 tau 蛋白,与肌萎缩侧索硬化和额颞叶痴呆相关的 TDP-43 蛋白等。”彭超说。
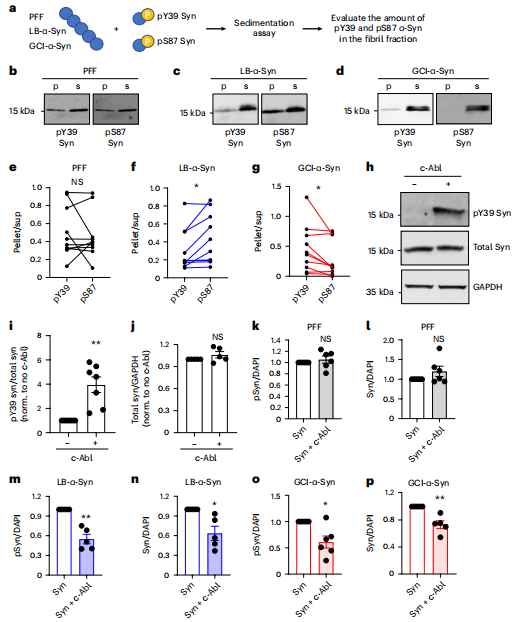
图丨可溶性 α-Syn 磷酸化可调节 GCI-α-Syn 和 LB-α-Syn 的扩增(来源:Nature Neuroscience)
在研究初期,该团队使用研究疾病理性 α-突触核蛋白折叠的常用手段——人造病理性蛋白。但他们很快发现,正常蛋白无论带有怎样的修饰,对人造蛋白的扩增都没有太大影响,既不增加也不抑制其扩展。
考虑到已经有很多证据证明,人造蛋白和患者脑中蛋白可能存在不同的结构,于是他们使用从患者脑中提取存真实的病理性 α-突触核蛋白,然后研究正常蛋白对于该病理性 α-突触核蛋白扩增的影响。
随后,有意思的现象缓缓展开。研究人员发现,正常蛋白的不同的修饰对患者脑中的病理性 α-突触核蛋白有很强的调控作用,可以改变它的扩增效率。
此外,研究人员还发现,可溶性 α-突触核蛋白对相关疾病中不同类型的患者得到的病理性 α-突触核蛋白,比如帕金森症、多系统萎缩症,它们的调控的方式或者效果并不相同,这说明可溶性 α-突触核蛋白的效应与病理性 α-突触核蛋白本身的结构特性息息相关。
“本来在研究前期我们使用人造病理性蛋白做实验以失败告终时还感到沮丧,但拿到用真实蛋白的实验相关结果,我们觉得异常兴奋。”彭超说道。
此前,可溶性 α-突触核蛋白中对于修饰的相关研究并不多见。如果想看蛋白修饰,常用的做法是把病理性 α-突触核蛋白抽取出后进行具体研究,少有研究人员去关注可溶性 α-突触核蛋白上面的修饰。
明确了研究方向,接下来要解决的是研究工具。该团队建立了一套高灵敏度的系统,通过对免疫沉淀法进行改进,拿到纯化的患者脑中的可溶性 α-突触核蛋白,从而得到很多新的修饰位点。
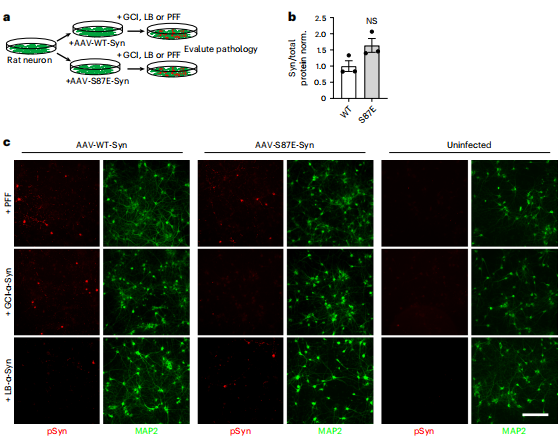
图丨可溶性 α-突触核蛋白的 PTMs 改变了病理 α-突触核蛋白在原代神经元中的扩散(来源:Nature Neuroscience)
探索一个全新的方向,除了解决棘手的技术问题,还意味着能随时面对不确定性,比如怎样应对在论文投稿过程中审稿人给出的难题。一般来说,研究人员会采用模拟修饰的方式来研究病理性 α-突触核蛋白在体外的扩增。但审稿人要求他们用真实的修饰位点、而非修饰模拟突变来进行核心实验。
与此同时,该团队还发现,做相关实验时效果并不理想,由于病理性 α-突触核蛋白提取自患者脑中,这导致每个实验在技术上的差异非常大。彭超表示:“我们在比较带修饰位点和不带修饰位点的蛋白后,发现二者并没有区别,因为它们本身的数据差异性太大了。”
于是,他们想到了一个新的办法——将带修饰位点和不带修饰位点的两种蛋白混在一起进行直接比较,最终回答了审稿人的问题。
下一步,该团队计划对其他相关疾病相关的蛋白继续研究,以确认是否有与该研究类似的现象。另一方面,该实验中发现了很多新的修饰位点,他们也将继续探索这些新修饰位点的具体作用。

致力于改进疾病的治疗方法,走“独特”的科研之路
彭超在武汉大学生命科学学院获得荣誉学士学位,博士毕业于复旦大学。之后,他在宾夕法尼亚大学进行了六年博士后训练,师从美国医学科学院院士、发明家科学院院士李文渝(Virginia Man-Yee Lee)和美国医学科学院院士、艺术与科学院院士约翰·特罗扬沃斯基(John Trojanowski)。
相关疾病诊断和治疗的困难在于疾病本身的多样性,而病理性 α-突触核蛋白结构的多样性与疾病的多样性密切相关,因此在博士后研究阶段,彭超确立了探索病理性 α-突触核蛋白结构多样性的方向,以理解相关疾病患者之间巨大的个体差异。
他表示,做疾病研究的最终目的是改进相关疾病的诊断或治疗方法,特别是将相关疾病患者进行细分,找到属于他们的精准治疗方案。
 图丨彭超团队合影(来源:该团队)
图丨彭超团队合影(来源:该团队)2020 年 1 月,彭超加入 UCLA,并成立独立课题组。其课题组利用最新一代的疾病模型,综合运用蛋白组学、多种转录组学、遗传学等方法,致力于研究多种相关疾病的发生发展机理,包括帕金森病、阿兹海默症、路易小体痴呆、多系统萎缩症等。
该团队坚持“用完全不同的思路去问重要的科学问题”,正是因为这种独特的科研理念,他们经常会发现那些科研中的“不寻常”。最近,彭超团队还发现了不同细胞的胞内环境会导致产生具有不同结构的病理性 α-突触核蛋白,从而首次揭示了在病人脑中不同的病理性 α-突触核蛋白结构的产生机制。
“我认为,研究课题不应蹭热点,而是坚持在领域内做自己独特的贡献。从不同角度去看待科研问题,走一条不寻常的路并证明是正确的,对我来说是科研工作中最大的动力。”彭超说。
实际上,神经退行疾病是一个很特别的领域,它的相关药物非常少,因此靠传统的“药到病除”来实现相关疾病的根治相当困难。并且,大量资本投入该领域后并未获得预期的成功,这说明研究相关疾病机制仍处于极度匮乏的状态。因此,必须对疾病的机制进行深入理解、在探索方面不断突破才可能解决疾病的治疗问题。
他认为,与“患病寻医”相比,真正实现治疗窗口,也就是在相关疾病早期就想办法阻断病理性 α-突触核蛋白的传播,是值得期待的新治疗方案。
另一方面,目前世界各国共同面临老龄化问题将在几十年内日益严重,神经退行性疾病是一种典型的老年病。因此,彭超认为这是一个亟需研究、又在未来很有希望的领域。
 参考资料:
参考资料:1.Zhang, S., Zhu, R., Pan, B.et al.Post-translational modifications of soluble α-synuclein regulate the amplification of pathological α-synuclein.Nature Neuroscience(2023). https://doi.org/10.1038/s41593-022-01239-7