原标题:观察|张锋公司体内基因编辑疗法初步结果公布,缘何股价暴跌 来源:澎湃新闻
2013年,“基因魔剪”CRISPR系统让基因编辑领域掀起新的高潮。2020年,埃马纽埃尔·卡彭蒂耶和詹妮弗·杜德纳两位CRISPR基因编辑系统的开发者也最终摘得当年的诺贝尔化学奖。
毫无疑问,基因编辑领域的发展让外界看到了治疗各种难治性遗传疾病的曙光。近年来,全球范围内陆续发起来针对多种疾病的基因疗法,希望证明在技术不断发展之下,这一疗法可以真正治疗人类疾病。
其中,外界对美国公司Editas Medicine (NASDAQ: EDIT)的期待已久。Editas是最早成立的生物技术公司之一,Editas公司总部位于马萨诸塞州剑桥,由基因编辑领域权威人物张锋及George M. Church等人于2013年11月联合创办,并于2016年1月成为CRISPR基因编辑领域首家发起IPO的公司。
 张锋
张锋此前的2018年12月,Editas宣布FDA已批准该公司EDIT-101药物的IND(新药临床试验)申请。2019年7月底,Editas和眼科巨头Allergan联合宣布,名为Brilliance的1/2期临床试验AGN-151587 (EDIT-101) 开始进行患者注册。
AGN-151587是一种正在开发的实验性药物,用于治疗Leber先天性黑蒙症10(LCA10),这是一种由CEP290基因突变引起的遗传性失明。值得外界关注的是,这项临床试验是世界上第一个基于第三代基因编辑技术CRISPR的基因编辑药物的体内研究。
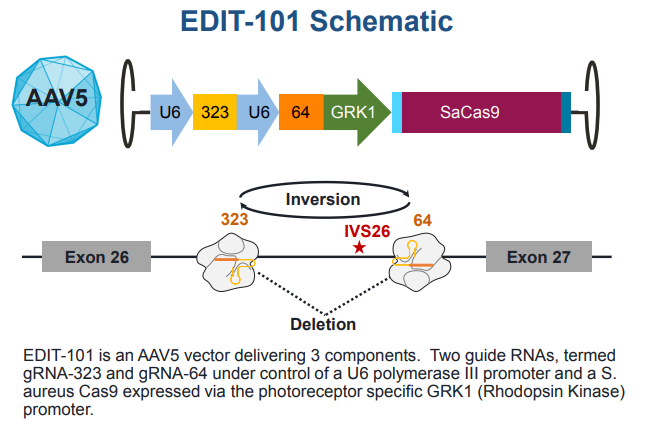 AGN-151587(EDIT-101)
AGN-151587(EDIT-101)然而,等待是漫长的。历经2年多之后,当地时间9月29日,Editas在第19届视网膜变性国际研讨会(RD2021)上终于发布了其正在研究的CRISPR基因编辑疗法EDIT-101的I/II期临床试验的初步临床试验结果。
或许初步结果并未达到外界的预期,消息公布后,Editas股价大跌,当天收盘价为42.50美元/股,下跌18.97%。实际上,这也屡见不鲜,医药创新公司的命运和临床试验中未知的风险息息相关。
“现在大家都在提的基因编辑,以前我们都觉得这事儿如果能做,会多么的有意义,但是在真正的技术成熟之前,没有人知道它能做还是不能做。”中国科学院外籍院士、北京生命科学研究所所长王晓东对澎湃新闻(www.thepaper.cn)记者表示,“它能做了以后,到底能做什么事儿?还需要很多更多的科学家来接着去研发,然后在这个过程中可能还有很多的技术门槛要克服。”
6名参与者早期数据:基本安全,疗效“复杂”
眼科疾病是基因疗法先行试验的热门领域。Leber氏先天性黑蒙症(LCA)是一种遗传性视网膜退行性疾病,目前已知至少有18个不同基因突变都会引起该疾病。LCA是儿童期遗传性失明最常见的原因,全世界每10万人中有2至3人患有这种疾病。LCA症状出现在生命的最初几年,随后将导致严重的视力丧失和潜在的失明。
而最常见的LCA10是一种由CEP290基因突变引起的单原性疾病,是20%-30% LCA患者的病因。Editas公司的AGN-151587 (EDIT-101)是一种正在开发的实验性药物,即用于治疗LCA10。据估计,美国和欧洲有几千名患有这种疾病的人。
目前进行的临床试验旨在评估AGN-151587(EDIT-101)在治疗LCA10患者时的安全性、耐受性和疗效。在此前公布的信息中,研究团队招募18名患者参与这项开放标签临床试验,入组患者包括成人和儿童(3-17岁)患者。患者可能被分为5个队列,接受3种不同剂量的基因编辑疗法。
按照计划,患者通过视网膜下注射EDIT-101单次给药。在给药后的1年里,患者每3个月接受一次监测,此后的两年里,监测频率降低。
此次该公司披露了前6名研究参与者的初步结果。安全性方面表明,通过眼睛视网膜下注射进行的治疗基本上是安全的。大多数不良事件(AEs)是轻微的,主要由手术过程和视网膜下注射引起,同时也没有产生剂量限制性毒性(DLTs)。
Editas方面称,没有严重的副作用或毒性,比如失去光感或持续炎症。一些患者有轻微的治疗相关炎症,口服类固醇可控制。共有4人经历了眼睛疼痛。未检测到Cas9特异性抗体或T细胞应答。到目前为止,还没有观察到与治疗相关的白内障、水肿或视网膜变薄。
相比之下,疗效数据更为复杂。疗效评估的依据是成人低剂量队列(n=2,6x10^11vg/ml)和成人中剂量队列(n=3,1.1x10^12vg/ml)中共5名受试者的可用数据,这些受试者在治疗后至少进行了3个月的随访。Editas公司首席医疗官Lisa Michaels表示,给前两名入组患者的最低剂量主要是为了评估安全性和潜在风险。Michaels于去年11月从拜耳加入Editas,她认为,“他们接受的治疗剂量被预测为可能带来益处的最低剂量。”
研究团队对这些患者进行了两项视觉功能测量和迷宫样导航测试。根据公司披露的数据,2名注射最低剂量的患者在功能性视力测试中没有显示出有意义的改善。成人中剂量队列中的3名患者的治疗表现出了希望,但分别出现了“不确定的变化”和“可变的数据结果”。
第一个纳入成人中剂量队列的患者是一名患有严重视力丧失的54岁妇女。Editas方面称,上述三个指标的早期变化在6个月后都持续了下来,显示出视力、视网膜灵敏度的改善,以及在较低光照水平下迷宫导航的能力。
“现在我能更清楚地看到线条了。有时我能用眼睛找到地板上的东西。”Editas在数据展示中援引了患者所说的话,“虽然不是一直这样,但我能比治疗前更多地注意到地板上的物体。”
中剂量队列受试者2在第3个月表现出视网膜敏感度改善,但视力没有显著变化。而对于第三名患者,Editas在报告中说,该患者前三个月的结果还是“不确定”。这两名患者的随访时间分别为5个月和3个月。
中剂量队列中的第四名患者接受了治疗,但在数据截止时至少有三个月没有被跟踪。Editas同时称,高剂量组和儿童队列的登记正在进行中。
业内:需要足够多的数据积累才能够真正看清
对于此次公布的初步结果,俄勒冈健康与科学大学分子和医学遗传学教授、该临床试验的首席研究员Mark Pennesi表示,“我对这些初步结果感到鼓舞,这些结果表明,这种基因编辑治疗迄今为止在该试验的参与者中获得了良好的耐受性,也可能有助于改善CEP290基因突变患者的视力。能够编辑人体内部的基因意义重大,我希望未来能够为我的LCA患者提供涉及基因编辑的新的治疗选择。”
Pennesi补充说,“这些令人鼓舞的结果为我们的体内基因编辑平台提供了概念证明,并增加了Editas对基因编辑技术在解决其他严重疾病方面的广泛潜力的信心。”
然而,值得一提的是,尽管该临床试验在中剂量组中表现出一定的疗效,但由于患者数量少,以及后续随访有限,结果还难以解释。这一局限性可能会让外界失望,尤其是在等待2年多之后。
但Michaels表示,公司需要展示其取得的进展。她认为此时公布数据也是在压力之下的一种博弈,“这个试验已经进行了这么长时间,我们一直没有和外界沟通,我认为拿出数据是很重要的。”
实际上,尽管Editas公司是在全球首家启动基于第三代基因编辑技术CRISPR的基因编辑药物体内研究的公司,但体内基因编辑的首个临床数据在今年6月已率先被另一家公司公布。
当地时间6 月 26 日,诺奖得主Jennifer Doudna 创办的 Intellia Therapeutics(NASDAQ:NTLA)和再生元(Regeneron,NASDAQ:REGN)共同发布了一项 CRISPR 候选药物的临床 I 期试验的中期数据,表明它能够对肝脏内的细胞进行基因编辑。当时发布的新闻稿指出,这是全球首个公布的体内CRISPR基因编辑疗法的临床试验结果。
同日,该实验结果还以题为“CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis ”的文章发表在权威医学期刊《新英格兰医学杂志》(NEJM)上。
不过,无论如何,Michaels认为,这对Editas来说都是一个“转折点”。这家公司自2019年Katrine Bosley卸任首席执行官以来,领导层也经历了重大变化,管理团队几乎均被替换。在Michaels之前的上一任首席医疗官也仅待了一年。
今年2月被Editas任命为首席执行官的资深生物技术高管James Mullen在接受媒体采访时曾坦言,公司的人事变动对公司产生了影响,“当你试图做艰难的事情时,稳定是很重要的。”
包括Editas公司在内的很多基因疗法公司都还将面临很长的路。国内基因编辑领域先锋博雅辑因(EdiGene)CTO袁鹏飞近日即对澎湃新闻(www.thepaper.cn)记者表示,“这个领域相对来说还是比较新的一个领域,我们还是需要足够多的数据积累才能够真正看清。”
除了CRISPR基因编辑疗法之外,其他的基因疗法在最近也有坏消息传出来。就在9月初,美国BioMarin(拜玛林)公司宣布,美国食品药品监督管理局(FDA)暂停了其AAV基因疗法BMN307的phaless 1/2期临床研究,同时该公司将暂停这项临床全球1/2期研究患者的进一步招募,直到调查完成。原因在于在给药52周的试验小鼠的肝脏剖检中发现肿瘤。更早几天的9月1日,日本制药公司安斯泰来也因严重的不良反应(肝毒性)暂停了基因疗法AT132的临床试验。
针对拜玛林的事件,袁鹏飞表示,这并不是临床上的问题,它是在小鼠身上发现了问题,它用了一个我们在临床转化上不可能用到的超高剂量,“但它敲响了一个警钟。”他提到一点,除了要积累更多的数据以外,对于目前上临床上已经有的应用,“对于它的剂量控制是不是要有更多的选择?我觉得也会非常重要。”
而对于国内的基因疗法创新公司而言,在这条探索的路上更为艰难。博雅辑因首席执行官魏东此前指出,生物科技的创新有着一个很明显的发展特点,即“群聚效应”,“ 比方说基因编辑的转化,群聚到了一种什么地步?世界上90%的的基因编辑转化能力都在美国,而在这90%之中,大概有80-90%都是在波士顿。”
目前在基因治疗的转化领域,魏东称,中国的企业尚有不小的差距。“无论是从监管还是在整个生态系统上去看,都还有很多的因素。”在注册性临床试验方面,中国在今年才跨出了真正的第一步。
 博雅辑因(EdiGene)首席执行官魏东博士
博雅辑因(EdiGene)首席执行官魏东博士今年的1月18日,博雅辑因宣布中国国家药品监督管理局药品审评中心已经批准其针对输血依赖型β地中海贫血的CRISPR/Cas9基因编辑疗法产品ET-01的临床试验申请。这是国内首个获国家药监局批准开展临床试验的基因编辑疗法产品和造血干细胞产品。博雅辑因科学创始人为北京大学生命科学学院教授魏文胜。
9月8日,博雅辑因宣布旗下子公司广州辑因针对输血依赖型β地中海贫血的造血干细胞基因编辑疗法产品ET-01的多中心I期注册性临床试验已于中国医学科学院血液病医院(中国医学科学院血液学研究所)完成首例患者入组。“我们在这上面已经打破了0的突破,也已经在国际上重新建立了中国怎么样做基因编辑转化的形象,我们希望未来会有更多的数据来表明我们在帮助更多的患者。”
“基因测序让我们对于疾病基因的原理了解得越来越多,这时候就促生了我们一定能够找到更好的方法,从基因上来治疗这个疾病。”魏东对澎湃新闻(www.thepaper.cn)记者表示,其颠覆性在于,“基因编辑带来的疗法效果是,能不能够一次性治愈?一旦往这条路走下去,我们就完全开辟了可治疗疾病的范围。”