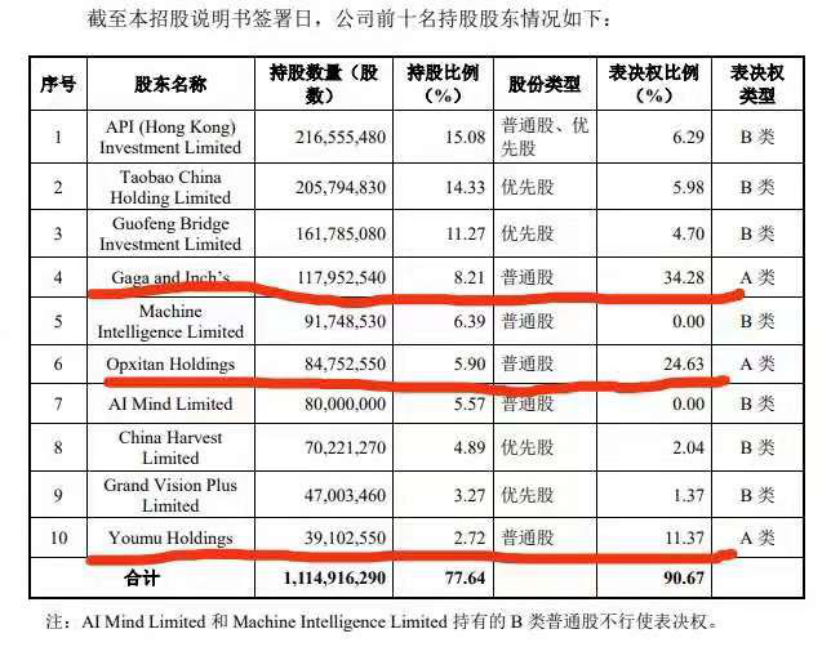
来源:第一财经
3月9日,国家药品监督管理局(NMPA)官网显示,荣昌生物一类新药注射用泰它西普(批准文号:国药准字S20210008)正式获批上市,适应症为系统性红斑狼疮(SLE)。

作为一家致力于发现、开发和商业化创新的、有特色的生物药物企业,荣昌生物上市至今总市值已达504.5亿港元(截至2021年3月11日收盘),其可持续模式亦获得富达、贝莱德、高瓴资本看好并加持。
疗效与安全性获验证
当下,生物制剂已成为治疗自身免疫性疾病的重要“利器”。
作为全球首个用于治疗系统性红斑狼疮(SLE)的“双靶”一类生物新药,泰它西普(商品名:泰爱)被证明拥有较好疗效与安全性。
由荣昌生物创制的泰它西普,是靶向BLyS 和 APRIL 的原创性抗体融合蛋白药物,而这两者正是B 淋巴细胞分化成熟的关键因子。

“抑制 BLyS和APRIL的过度表达,能更加有效地降低机体免疫反应,达到治疗自身免疫疾病的目的。”业内人士解释。
而在2019年底,美国风湿病学会(ACR)年会召开,泰它西普相关临床数据在主会场做口头报告,引起国际业界强烈反响。
一项多中心、随机、双盲、安慰剂对照研究结果显示,入组249例SLE患者中,160/240毫克泰它西普组的SRI4应答率分别为68.3%和79.2%,均显著优于安慰剂组的33.9%。
泰它西普的主要适应症为系统性红斑狼疮(SLE),该适应症已获批在美国开展全球多中心III期临床试验。
那么,泰它西普在安全性方面表现如何?
记者从荣昌生物了解到,上述II期临床试验治疗组呼吸道感染、注射部位反应等不良事件的发生率和严重程度、不良事件导致的剂量调整或停药发生率等基本与安慰剂组相当。
值得注意的是,更新版的《2020中国系统性红斑狼疮诊疗指南》(简称《指南》)中,首次推荐贝利尤单抗和利妥昔单抗(未获批SLE适应症)这两种生物制剂,来用于常规治疗效果不佳、不耐受或复发的患者。
其中,贝利木单抗是目前全球唯一一种用于系统性红斑狼疮治疗的BLYS单靶点药物,而此次获批上市的泰它西普,则是全球首创的BLyS和APRIL双靶向生物药物。
除了疗效与安全性外,泰它西普的市场容量究竟有多大?
根据弗若斯特沙利文数据显示,全球系统性红斑狼疮治疗生物药市场的销售收益由2015年的约5亿美元增加至2019年的8亿美元,复合年增长率为22.1%,预期将进一步按复合年增长率29.3%增加至2030年的132亿美元。
更多适应症有待开发
事实上,泰它西普是荣昌生物在研产品管线中进展最快的品种,且是公司第一款实现商业化的重磅产品。
记者此前了解到,为了应对泰它西普的可持续生产,荣昌生物在现有的1.2万升发酵规模基础上,已开工建设三期工程。
预计到2021年底,荣昌生物的整体发酵规模将增加到3.6万升,2025年将达8万升,能够充分保证国内、国外市场的商业化需求。

更加令人惊喜的是,泰它西普正积极开展用于其他自身免疫性疾病的开发。
比如,泰它西普关于治疗类风湿关节炎、视神经脊髓炎频谱系疾病的Ⅲ期临床试验正在进行中,针对lgA肾炎、干燥综合症、多发性硬化症及重症肌无力等疾病的II期临床试验也在开展。
根据弗若斯特沙利文的资料,中国IgA肾病患病率较高,2019年为220百万名患者,估计到2030年的患者人数将达240万名。目前,世界上并无批准用作治疗IgA肾病的生物药。泰它西普是唯一进入中国临床试验治疗IgA肾病的生物药。
“未来,荣昌生物将完成三个转变:由一个单纯的研发型公司向综合型商业化公司转变,由一个区域性公司向全球化公司转变,由单纯的科技创新驱动到由技术、资本、市场等多元素驱动发展的转变。”荣昌生物联合创始人、CEO兼CSO房健民博士这样表示。