原标题:【深度】仁会生物IPO注册一年未果,核心降糖药产品临床试验再引争议
 图片来源:视觉中国
图片来源:视觉中国临床试验登记网站ClinicalTrials最近公示了科创板拟上市公司仁会生物核心品种贝那鲁肽的一项临床试验,头对头研究比较贝那鲁肽和礼来长效降糖药度拉糖肽二者的降糖效果。

ClinicalTrials上的该临床试验登记情况
贝那鲁肽是一款自获批以来就争议不断的产品,临床试验显然是其证明自己的最好方式。不过,这个临床试验的设计和意义却让人颇为“看不懂”。
此外,早在一年前仁会生物就已在科创板上市委审议中成功过会,但迄今为止依然未能成功注册,并在证监会现场检查中被重点问询,IPO注册至今“难产”。
而随着今年科创板IPO收紧,发审委对科创属性关注度提高,仁会生物的IPO之路还是个未知数。
争议临床试验
根据仁会生物官网介绍,贝那鲁肽(谊生泰)是全球唯一一款全人源GLP-1类药物,GLP-1受体激动剂被认为是目前降糖效果最好的一类降糖药。在国内,目前共有包括贝那鲁肽在内的8个GLP-1受体激动剂获批,而从数据上看,礼来的度拉糖肽、诺和诺德的利拉鲁肽和司格美鲁肽被认为是其中最好的三款。
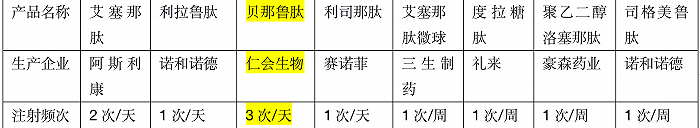
目前国内获批的几款GLP-1受体激动剂情况
因此,贝那鲁肽选择与度拉糖肽进行头对头研究,其目的非常明确,便是希望在疗效上证明自己足够出色。某知名医学院教授孟亚华告诉记者,如果此次头对头比较结果显示贝那鲁肽效果更好,企业确实可以作为一个销售点进行产品宣传。
研究方案显示,本次研究由中南大学湘雅二医院院长,国家代谢性疾病临床医学研究中心主任周智广牵头,在广东省人民医院、哈尔滨医科大学第一附属医院、河南科技大学第一附属医院、中南大学湘雅二医院展开研究,预计入组120人.
而根据研究方案,贝那鲁肽组受试者将每1天接受3次贝那鲁肽注射,度拉糖肽组受试者将每7天接受1次度拉糖肽注射,然后比较两者的降糖效果。
长期从事新药临床开发工作人士Klaith告诉记者,糖尿病是慢性病,不仅需要长期用药甚至注射给药,还必须配合生活方式改变、饮食控制。如果血糖控制不稳定,患者不得不频繁手指扎针测血糖,相当痛苦。
Klaith解释,为了改善患者管理效果,糖尿病治疗企业一直在优化给药途径、频次,尽可能开发口服药,尽可能减少注射次数,以减少患者痛苦,提高依从性。
而目前上市的所有GLP-1受体激动剂都只能通过注射方式给药,此次与贝那鲁肽头对头比较的度拉糖肽,则通过融合蛋白技术1延长半衰期,实现1周1次长效注射。
而贝那鲁肽由于半衰期极短(仅为几分钟),进入到血液循环中后会迅速被二肽基肽酶4(DPP-4)快速分解而失去促胰岛素分泌活性。因此,患者每天需要接受多次注射给药。
这也就意味着,就算这项贝那鲁肽头对头比较度拉糖肽的研究成功了,也只能证明贝那鲁肽在1天3针的情况下才能优于7天1针的度拉糖肽,这对于本就需要经常扎针的糖尿病患者来说颇为痛苦,严重影响患者依从性。
而另外一个值得注意的点是,此次研究中,贝那鲁肽组还会在每3-7天提升1次剂量,最高提升至2.0 mg,然而贝那鲁肽在上市时所被批准的最高给药剂量仅为0.2mg,两者相差有十倍之多。Klaith指出,如果2.0 mg剂量属实,则属于超说明书应用,且缺乏足够安全性数据支持,作为上市后临床研究不妥,应按照3期临床试验标准管理、执行。
因此,从药物经济效益上看,这项研究即使成功,它的现实意义究竟又有多少,是否是对临床研究资源的一种无意义占用?
对这项临床试验,仁会生物对记者回应称,临床用药的根本目的,是为了取得更好的疗效。公司希望看到贝那鲁肽在与同类药物的比较中能够显现出更好的降糖、减重优势,从中国的指南建议和国际上针对重要意见领袖专家的调查来看,对治疗糖尿病的药物而言,都更加看重安全性和有效性等因素。
关于依从性的问题。仁会生物则回应称,评价一款治疗药物,往往以指南的建议为主,《中国2型糖尿病防治指南(2017版)》在“2型糖尿病高血糖治疗简易路径”中强调了“药物疗效”、“安全性”、“卫生经济性”三个方面的特性以及“我国国情”,并未将“依从性”等其他影响因素纳入考虑。
不过仁会生物或许忽略了,如果一款药品无法保障良好的患者的依从性,其疗效则无从谈起。由此看来,从患者的依从性角度出发,贝那鲁肽与其他产品相比处于劣势,而因其疗效上也被业界质疑,孟亚华甚至认为这是一款me worse(更差)的产品,他表示:“除非价格比较低,使得部分人愿意使用这款药。”
昔日数据相差悬殊,贝那鲁肽药效存疑
实际上,自从上市之始,贝那鲁肽的一直备受争议。
对于糖尿病来说,判断一款药物有效性的主要依据是HbA1c(糖化血红蛋白)的降低幅度。贝那鲁肽3期临床结果显示,其HbA1c的降低幅度为0.26%,降糖效果较为微弱。
相比之下,此前多个研究显示,接受度拉糖肽0.75mg和1.5 mg治疗26周后,患者HbA1c降幅分别达到1.22%和1.48%;接受1日1次利拉鲁肽治疗的患者HbA1c降幅在0.7%左右;1周1次注射不同剂量司格美鲁肽治疗的患者HbA1c降幅则在2%上下。
相比之下,贝那鲁肽的效果究竟如何,似乎已是一目了然。
然而,仁会生物的官网上贝那鲁肽介绍页面中,并未对其3期临床试验结果进行介绍,反而是挂出了一份“贝那鲁肽真实世界研究数据”的研究论文,以及一份题为“贝那鲁肽真实世界研究数据振奋人心”的官方解读文章。
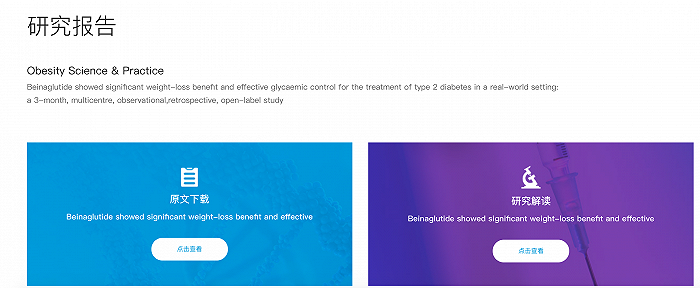
仁会生物官网上贝那鲁肽介绍页面
仁会生物称这是一项“多中心、回顾性、观察性研究”,纳入了来自中国两家中心(唐山市迁安燕山医院、秦皇岛市中医医院)的314例二型糖尿病患者,在常规诊疗环境下接受贝那鲁肽治疗。是“首个公开报道的贝那鲁肽在真实诊疗环境中的用药数据”。
而吊诡的是,在这项研究中,贝那鲁肽的HbA1c降低幅度高达2.87%,不仅远超此前自己的3期临床试验数据,甚至也远远超过了同类的GLP-1产品。

仁会生物官网上相关解读
同一个药物,为何两项临床试验却呈现出差异巨大的研究结果。
Klaith向记者详细解读了贝那鲁肽这一“真实世界研究数据”的论文。他表示,该研究是回顾性观察研究,即把过往的临床数据拿出来分析,数据质量可能严重偏倚,因此在循证医学体系中证据级别较低。而所谓“多中心”,其实也只有两家地方医院的数据。相比之下,3期临床试验常见的前瞻性随机对照研究,证据级别更高,更具说服力。
孟亚华也告诉记者,一般来说,药物的效果要以3期临床试验为准。相比于上市后的真实世界研究,3期临床试验才是关键性的,严格遵从多中心、双盲、随机对照的原则,把对照组和试验组经过设计,让两组人群有非常高的可比性,而且有代表性。4期临床试验是对3期的确认,不能把结果作为效果的比较。“像新冠疫苗的真实世界数据跟临床可能有差异,是因为毒株种类改变了,但是糖尿病并不会变。”孟亚华解释道。
但仁会生物却表示,一方面,3期临床试验和上市后的研究是两个不同类型的研究,方案设计不同,入组患者不同,数据没有可比性。另一方面却又称随机对照临床试验的结局测量多以一个或者一些特定病症或体征为评价目标,而真实世界研究结局测量多采用有广泛临床意义的指标,“更具临床实用价值”。
而对于此前的3期临床数据仁会生物强调,贝那鲁肽3期临床中显示HbA1c的组间差异具有统计学意义,就表明药品具有效力,
此外,贝那鲁肽的销售情况也并不理想,虽然其已被纳入国家医保,但2017年、2018年和2019年贝那鲁肽的销售金额分别仅为1360.71万元、2681.69万元和5588.08万元。
面对低迷的销售量,仁会生物在招股书中解释道,降糖药物市场相对成熟,贝那鲁肽进入该领域的时间较晚,所占市场份额相对较低,且目前仍处于市场导入期。
IPO罕见卡壳一年多
核心产品备受质疑的背后,是仁会生物科创板IPO在过会后却被“卡壳”1年多时间,目前仍处于证监会问询阶段。

上交所官网科创板板块中仁会生物IPO进度
2020年7月31日,仁会生物注册申请顺利通过科创板上市委审议,成功过会。当年8月,仁会生物即向证监会提交注册稿。然而1年多时间过去了,公司依然处于证监会问询阶段,目前总共收到过三轮问询函。根据此前21世纪经济报道消息,仁会生物在在证监会现场检查中多项问题突出。公司经营的诸多疑点暴露,被监管层重点问询,目前还未见仁会生物回复意见。
这些问题包括,被仁会生物列入销售费用举办的学术推广会中,公司销售人员直接用现金支付讲课人员劳务费,但是销售人员报销费用和流水记录之间出现多处不匹配问题。此外,仁会生物参与的部分会议甚至未能提供有效的参会证明,还出现了销售人员购买假发票的情况。
现场检查中,仁会生物甚至出现疑似商业贿赂的异常流水,被证监会现场检查中点名关注。如2017年至2020年期间,仁会生物存在大额购买杉德礼品卡的支付记录,并根据领用部门性质在账务上作为管理费用、制造费用、研发支出处理,但相关礼品卡缺少发放及领用的书面记录佐证。
而相比之下,2017-2019年间,仁会生物的销售费用分别高达6059.15万、8532.75万、1.54亿。






![[图]Chrome大幅优化“管理搜索引擎”页面](https://n.sinaimg.cn/spider20210824/353/w700h453/20210824/179c-4e0630cec170fa1a2b1ca0896e97ae53.jpg)